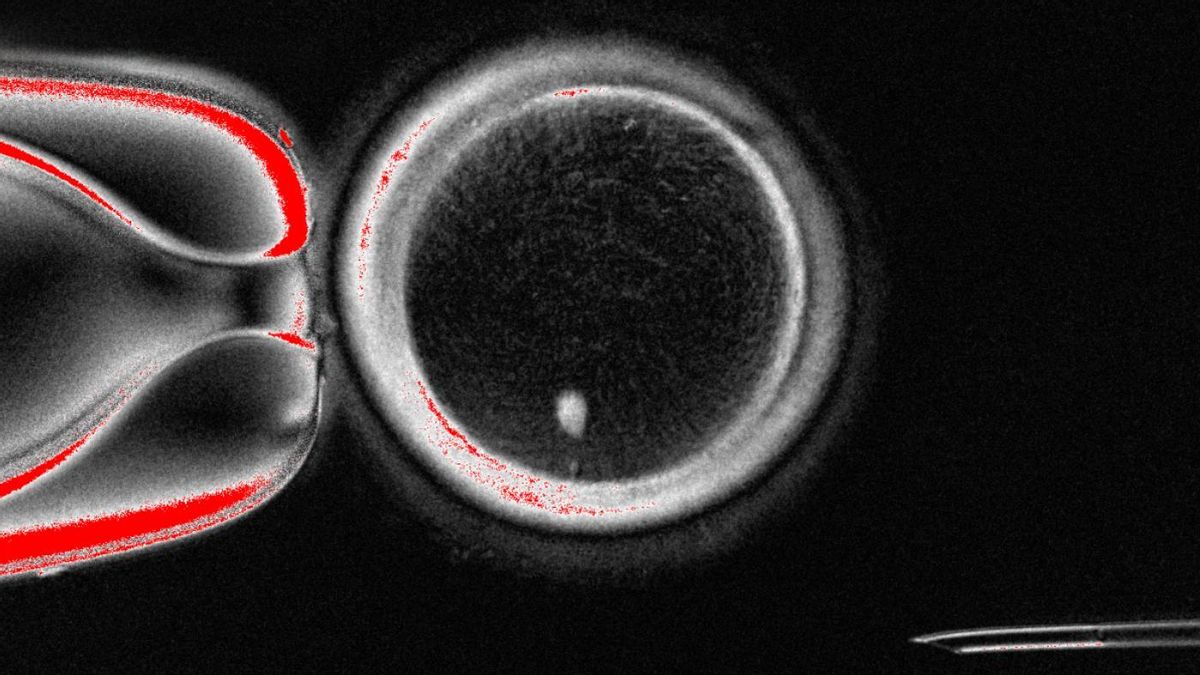
Consiguen por primera vez generar óvulos humanos potencialmente fecundables a partir de células de la piel
El avance muestra que la reprogramación celular podría ser una nueva vía para abordar la infertilidad en humanos y un paso para ayudar a muchas mujeres que han perdido sus óvulos a tener hijos con su propia carga genética, según los expertos
Hemeroteca – La natalidad se desploma pero los nacimientos por reproducción asistida crecen: ya son uno de cada diez
Un equipo internacional de investigadores ha logrado generar óvulos humanos fecundables a partir de células de la piel. Según los autores, esta novedosa técnica ofrece una vía para abordar la infertilidad, aunque reconocen que se necesita más investigación para garantizar la eficacia y la seguridad antes de futuras aplicaciones clínicas.
En un trabajo publicado este martes en la revista Nature Communications, el equipo de Shoukhrat Mitapilov describe cómo extrajeron el núcleo de células somáticas de la piel y lo insertaron en ovocitos de donantes sin núcleo. Esta estrategia, conocida como transferencia nuclear de células somáticas, consiste en tomar el núcleo de una de las células somáticas del propio paciente (como las de la piel) y trasplantarlo a un óvulo de un donante con el núcleo extraído.
De cara a la reproducción, esta técnica se enfrenta a una importante dificultad: los gametos (óvulos y espermatozoides) tienen la mitad del número habitual de cromosomas (un juego de 23), mientras que las células generadas a partir de la transferencia nuclear de células somáticas contienen dos juegos de cromosomas humanos (46), lo que causaría que los cigotos posteriores tuvieran un juego adicional de cromosomas.
Forzando el descarte
Los autores han resuelto este problema del juego extra de cromosomas induciendo un proceso denominado “mitomeiosis”, que imita la división celular natural y provoca el descarte de un juego de cromosomas, dejando un gameto funcional. El proceso produjo 82 ovocitos funcionales, que fueron fecundados con espermatozoides en el laboratorio. Una pequeña proporción de estos óvulos fecundados (aproximadamente el 9%) se desarrolló, al sexto día post-fecundación, hasta la etapa de blastocisto. Sin embargo, no se cultivaron blastocistos más allá de este punto, que coincide con el momento en que normalmente se transferirían al útero en un tratamiento de fecundación in vitro.
La infertilidad afecta a millones de personas en todo el mundo y puede ser causada por la disfunción o ausencia de una de las dos células sexuales (gametos) —el ovocito (óvulo) o el espermatozoide— necesarias para producir un cigoto (un óvulo fecundado). En algunos casos, la fertilización in vitro convencional puede ser ineficaz.
Los autores señalan varias limitaciones en su estudio, como que de los 82 ovocitos funcionales generados y fecundados, solo el 9% llegó a desarrollarse hasta el día 6, momento del fin del experimento. Además, los embriones presentaban anomalías cromosómicas. Sin embargo, consideran que esta prueba de concepto demuestra que este proceso es potencialmente factible en células humanas, lo que abre el camino a futuras investigaciones sobre la técnica.
“Un avance espectacular”
El genetista y experto en bioética Lluis Montoliu (del CNB-CSIC, CIBERER-ISCIII) considera que se trata de “un avance espectacular” que añade una nueva posible estrategia para conseguir óvulos en reproducción asistida. “Uno de los sistemas es diferenciarlos in vitro, pero esto es algo muy experimental que no está autorizado”, explica a elDiario.es. “Lo que plantean es otra manera de conseguir un óvulo, que es utilizar el núcleo de cualquier otra célula somática y reducirle los cromosomas a la mitad para convertirlo en un óvulo funcional. Y lo han validado con las fases iniciales del desarrollo de un embrión humano”.
Lo que plantean es otra manera de conseguir un óvulo, que es utilizar el núcleo de cualquier otra célula somática y reducirle los cromosomas a la mitad para convertirlo en un óvulo funcional
Rocío Núñez Calonge, directora científica del Grupo UR Internacional y coordinadora del Grupo de Ética de la Sociedad Española de Fertilidad, cree que este estudio piloto demuestra que la reprogramación celular podría ser una vía posible para tratar la infertilidad en humanos, aunque se necesita más investigación para garantizar su eficacia y seguridad antes de su aplicación clínica.
Aunque esto sigue siendo un trabajo de laboratorio muy temprano, en el futuro podría transformar cómo entendemos la infertilidad
En opinión de la experta, además, hay que tener en cuenta las importantes consideraciones éticas del estudio. “De hecho, hace ya algunos años, el Comité de Ética de la Sociedad Americana de Reproducción publicó un documento donde presentó varios argumentos éticos en contra del uso de la transferencia nuclear de células somáticas para el tratamiento de la infertilidad debido a las preocupaciones sobre su seguridad, los posibles efectos desconocidos en los niños, las familias y la sociedad, y la existencia de otros métodos de reproducción asistida que son éticamente aceptables”, recuerda en declaraciones al SMC España.
Un cambio en la infertilidad
Ying Cheong, profesora de Medicina Reproductiva de la Universidad de Southampton, considera la prueba de concepto emocionante. “En la práctica, los médicos están viendo cada vez más personas que no pueden usar sus propios óvulos, a menudo debido a la edad o a condiciones médicas”, explica al SMC. “Aunque esto sigue siendo un trabajo de laboratorio muy temprano, en el futuro podría transformar cómo entendemos la infertilidad y el aborto espontáneo, y quizás algún día abrir la puerta a la creación de células similares a óvulos o espermatozoides para quienes no tienen otras opciones”.
Este estudio es un paso para ayudar a muchas mujeres que han perdido sus óvulos a tener hijos con su propia carga genética
“Muchas mujeres no pueden tener una familia porque han perdido sus óvulos, lo que puede ocurrir por una variedad de razones, incluyendo después de un tratamiento contra el cáncer”, añade Richard Anderson, de la Universidad de Edimburgo. “Habrá preocupaciones de seguridad muy importantes, pero este estudio es un paso para ayudar a muchas mujeres a tener hijos con su propia carga genética”.


